Sechs Monate nachdem die ersten COVID-19-Impfungen in den Vereinigten Staaten in die Arme gingen, hat sich das Impftempo verlangsamt. Das hat Beamte des Weißen Hauses dazu veranlasst, ihr Ziel, bis zum 4. Juli mindestens eine Dosis auf 70 Prozent aller US-Erwachsenen zu erhalten, zurückzuschrauben; sie streben jetzt 70 Prozent der 27 und älteren an.
Laut einer aktuellen Umfrage der American Psychiatric Association sagt jedoch mehr als jeder fünfte Amerikaner, dass er sich nicht impfen lässt. Zu den häufig auftauchenden Gründen gehört die Sorge, dass die Impfstoffe zu schnell entwickelt wurden: Normalerweise dauert die Arzneimittelforschung Jahre oder sogar Jahrzehnte von der Idee bis zur Realität. Die ersten Impfstoffe zur Bekämpfung von COVID-19 wurden innerhalb von 11 Monaten entwickelt, getestet und für den Notfall zugelassen.
Angetrieben von einer globalen Dringlichkeit und untermauert durch jahrzehntelange Arbeit an der Impfstofftechnologie, fanden die Impfstoffentwickler einen Weg, nicht nur Tage oder Monate, sondern Jahre vom Zeitplan zu verkürzen (SN: 21.02.20). Nicht die Wissenschaft oder die Sicherheitstests wurden über Bord geworfen, sondern die in den Entwicklungsprozess eingebaute Wartezeit – das Warten auf Ergebnisse und das Warten auf behördliche Genehmigungen (SN: 10.07.20).
Durch den Vergleich der neuen Impfstoffe mit früheren Medikamenten, die die gleiche Technologie im Rahmen traditionellerer Forschungszeitpläne verwendet haben, ist es möglich, ungefähr zu berechnen, wie viel Zeit der Entwicklungsprozess verkürzt wurde, nachdem die Schüsse bereit waren, in die Waffen zu gehen: ungefähr vier Jahre. Hier ist wie.
Die Geheimnisse des Coronavirus lüften
Um ein wenig zu sichern, begann die Entwicklung der Impfstoffe viel früher als das Stadium der Waffenstöße. Es begann mit der Entschlüsselung der genauen genetischen Ausstattung von SARS-CoV-2, dem Virus, das COVID-19 verursacht (SN: 12.11.20). Anfang Januar 2020 war dieser genetische Bauplan in Hand und die ersten zu testenden Impfstoffe waren nur wenige Wochen später fertig.
Aus gewisser Sicht entschlüsselten oder sequenzierten Forscher zuerst das gesamte menschliche Genom über einen Zeitraum von fast 13 Jahren, beginnend im Jahr 1990 bis zum Abschluss im Jahr 2003 (SN: 17.01.03). Aufgrund der Fortschritte bei Computern kann dieselbe Aufgabe jetzt nur noch Stunden dauern.
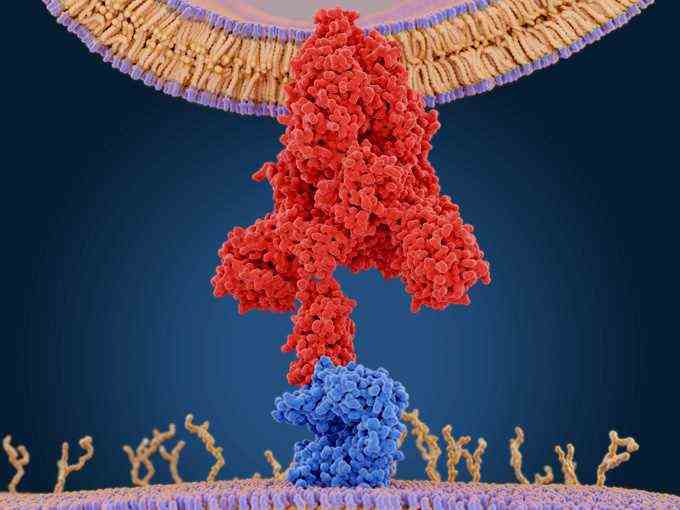
Am wichtigsten war, dass die Forscher nun die genetischen Anweisungen für die Herstellung der Spike-Proteine hatten, die das Virus verwendet, um in Zellen einzudringen – ein wichtiger Bestandteil für die Herstellung der Impfstoffe. Diese Spike-Proteine ragen aus der Virusoberfläche heraus und sind ein leicht zu erkennendes Ziel für das Immunsystem. Dank jahrzehntelanger Arbeit an Coronaviren, darunter zwei, die andere Ausbrüche von menschlichen Krankheiten verursacht haben – SARS und MERS – wussten die Forscher, dass sie sich auf diese Proteine konzentrieren konnten. Diese Arbeit identifizierte auch die beste Form des zu verwendenden Proteins: eine stabile Form, kurz bevor das Virus mit einer Zelle verschmilzt, die es infizieren wird.
Ein Liefersystem finden
Diese Anweisungen könnten dann direkt in vorgefertigte Liefervehikel eingeschleust werden, die den genetischen Code zu den Zellen transportieren, um eine Immunantwort auszulösen. Wissenschaftler hatten diese schnellen, genetisch basierten Vorlagen bereits vor allem wegen des anhaltenden Kampfes gegen HIV entwickelt, sagt Tom Denny, Chief Operating Officer des Duke Human Vaccine Institute in Durham, NC
„In den letzten 10 bis 15 Jahren gab es große Teams auf der ganzen Welt … die versuchten zu verstehen, was passieren musste, um einen schützenden HIV-Impfstoff herzustellen“, sagt Denny. Diese Bemühungen haben „uns in unserem Kampf gegen diese aktuelle Pandemie geholfen“.
Diese Fahrzeuge sind wie die Potato Head-Spielzeuge der Welt der Impfstoffentwicklung: Anstatt verschiedene Gesichtsmerkmale auszutauschen, werden spezifische Informationen für jeden Virus eingesteckt.
Denny nennt es „Plug-and-Play“-Impfstoffherstellung. Die jahrzehntelangen Versuche, HIV anzugreifen, haben eine Bibliothek sicherer Waffen geschaffen, die schnell gegen neue potenzielle virale Plünderer eingesetzt werden können. „Wir hatten Glück“, sagt Denny, dass die entwickelten Plattformen bei diesem neuen tödlichen Virus so gut funktioniert haben.
Eine der Matrizen trägt einen nicht funktionsfähigen Teilstrang viraler mRNA direkt zu Zellen im Körper und gibt diesen Zellen Anweisungen, Kopien des Proteins zu erstellen, das das Immunsystem als fremd erkennt. Das wird in den Aufnahmen von Pfizer-BioNTech und Moderna verwendet.
Die mRNA für die Spike-Proteine des Coronavirus wird in winzige Fettbläschen verpackt, die als Lipid-Nanopartikel bezeichnet werden. Diese winzigen Fettbläschen gibt es seit Jahrzehnten und werden sicher für Dutzende anderer Medikamente verwendet, von denen einige zugelassen sind, andere noch in der Pipeline. Alles, was also geändert werden musste, um auf SARS-CoV-2 abzuzielen, waren die darin enthaltenen Anweisungen.
Der Inhalt der Fettblasen wird als ihre „Nutzlast“ bezeichnet, sagt Vicki Stronge (SN: 20.11.20). Sie ist Direktorin des Produktmanagements bei Precision NanoSystems in Vancouver, das Geräte und Verbindungen für die Entwicklung von Lipid-Nanopartikeln herstellt. Sie erklärt, warum diese Fettblasen so wichtig sind: Wenn die mRNA allein außerhalb einer Blase injiziert wird, zerfällt sie schnell und zerfällt in harmlose biologische Rohstücke, die von unserem Körper recycelt werden.
Von früheren Forschungen profitieren
Zwei Schlüsseltherapien – eine noch in Arbeit und eine genehmigt – ebneten den Weg für COVID-19-Impfstoffentwickler, um mit RNA-basierten Vorlagen durchzustarten.
Eine Therapie des in Deutschland ansässigen Unternehmens CureVac ist der erste Impfstoff, der am Menschen getestet wurde und der mit mRNA zur Bekämpfung einer Infektionskrankheit entwickelt wurde. Es zielt auf das Tollwutvirus ab und wurde menschlichen Freiwilligen ab 2013 injiziert. Jahrzehnte zuvor, im Jahr 1971, entwickelten Forscher die ersten Spritzen, von denen sie dachten, dass sie für den Menschen sicher seien, und testeten sie zunächst, indem sie sich selbst injizierten. Die erste Version des mRNA-basierten Tollwutimpfstoffs löste nur eine schwache Reaktion des Immunsystems aus, zeigte aber, dass die Technologie sicher war. Eine neuere Version dieses Tollwutimpfstoffs zeigt in klinischen Studien vielversprechende Ergebnisse. (CureVac entwickelt auch einen mRNA-COVID-19-Impfstoff, obwohl die ersten Ergebnisse enttäuschend waren.)

Die andere Therapie ist Patisiran, ein RNA-basiertes Medikament für eine seltene, aber oft tödliche Erbkrankheit, bei der sich Amyloidproteine in Nerven und einigen Organen ansammeln. Es verwendet das gleiche Design auf der Grundlage von Lipid-Nanopartikeln wie die mRNA-basierten COVID-19-Impfstoffe, nur mit einer anderen Nutzlast im Inneren.
Jahrelange Daten aus der Überwachung von Patienten, denen diese in Lipid-Nanopartikel eingehüllten RNA-Fragmente injiziert wurden, zeigen, dass sie sicher sind, sagt Sascha Tuchman, Hämatologe und Onkologe an der University of North Carolina in Chapel Hill, der eine Stelle für die Phase-III-Patisiran beaufsichtigte Versuche. Patienten, die eine Dosis Patisiran erhalten, haben ein geringeres Risiko für Nebenwirkungen als Patienten, die Injektionen mit Placebo-Kochsalzlösung erhalten. Und was die langfristigen negativen Folgen von RNA- und Lipid-Nanopartikeln angeht, sagt Tuchman: „Wir haben in Bezug auf die Sicherheit nichts zusätzliches gesehen, das darauf hindeuten würde, dass es Grund zur Besorgnis gibt.“
Sechs Jahre nachdem die ersten Spritzen getestet wurden, genehmigte die FDA Patisiran, etwas schneller als das Standardtempo für neue Behandlungen. Das macht es zu einem guten Vergleich, um zu zeigen, wo die COVID-19-Impfstoffe Zeit sparen konnten, abgesehen von den jahrzehntelangen Entwicklungsforschungen, die uns an diesen Punkt gebracht haben. Also lass uns die Uhr starten.
Rekrutieren von Freiwilligen
Nachdem die ersten Spritzen des prospektiven COVID-19-Impfstoffs aus den „Plug-and-Play“-mRNA-Labors auftauchten, wurden Jahre aus der Zeitleiste gestrichen, indem die langen Abschnitte des reinen Wartens, die in die meisten Humantests eingebaut sind, gestrichen wurden. Angetrieben von der Dringlichkeit der Pandemie hatten allein in den USA innerhalb weniger Monate fast eine halbe Million Menschen ihre Deltamuskeln über das COVID-19-Präventionsnetzwerk angeboten, in vielen Fällen sogar noch bevor die ersten öffentlichen Anzeichen von Erfolgen bekannt waren an die Amerikanische Ärztekammer.
Es dauerte beispielsweise knapp 16 Wochen, um mehr als 43.000 Freiwillige für die letzten Testphasen des Impfstoffs von Pfizer zu rekrutieren und anzumelden. Als 2013 die Rekrutierung von Freiwilligen für klinische Studien mit dem Tollwut-mRNA-Impfstoff begann, dauerte es 813 Tage, bis 101 Teilnehmer aufgenommen wurden. Basierend auf diesem Vergleich sind das allein beim Recruiting rund 730 Tage – also fast zwei Jahre – eingespart.

Schnelle Ergebnisse erzielen
Ein weiterer, düsterer Faktor trug zur wissenschaftlichen Geschwindigkeit bei: Wie schnell sich das Virus verbreitete.
Wissenschaftler können damit beginnen, die Wirksamkeit eines Impfstoffs zu berechnen, wenn eine ausreichende Anzahl von Personen in der Gruppe, die anstelle eines Impfstoffs ein Placebo erhalten hat, sich auf natürliche Weise infiziert hat (SN: 10/4/20). Wenn ein Ausbruch ausläuft, dauert es länger, diesen Schwellenwert zu erreichen. Das gilt auch, wenn sich ein Virus auf natürliche Weise langsamer ausbreitet – zum Beispiel ein Virus wie HIV, Herpes oder humanes Papillomavirus oder HPV, die hauptsächlich durch Sex übertragen werden. Im Gegensatz dazu kann nur durch Atmen oder Sprechen SARS-CoV-2 verbreitet werden – und das tut jeder (SN: 02.04.20).
Der lose Vergleich von Impfstoffstudien für COVID-19 mit HPV-Impfstoffstudien bietet Hinweise darauf, wie viele Tage möglicherweise aufgrund der astronomischen Ausbreitungsrate des neuen Virus von der COVID-19-Zeitachse abgeschnitten wurden. Die HPV-Studien dauerten etwa 529 Tage oder 1,4 Jahre, um einen Punkt zu erreichen, an dem die Wirksamkeit berechnet werden konnte, als die Placebo-Gruppe eine Infektionsrate von 3,8 Prozent erreichte.
Die Phase-II/III-Coronavirus-Studie von Pfizer hingegen erzielte in nur 105 Tagen erste Wirksamkeitsergebnisse für die erste ihrer beiden Dosen, als sie in der Placebo-Gruppe eine Infektionsrate von fast 2,4 Prozent erreichte. Das ist 424 Tage schneller als HPV. Warum? Denn nur wenige Monate nach Beginn der Pandemie infizierte SARS-CoV-2 täglich Hunderttausende von Menschen weltweit.
Über die Linie springen
Die Wartezeit wurde auch durch den Überprüfungsprozess der US-amerikanischen Food and Drug Administration wieder hereingeholt. Normalerweise dauert es 10 Monate, bis die FDA ein neues Medikament überprüft.
Mit der steigenden Zahl der COVID-19-Todesopfer drängte die FDA jedoch alle Coronavirus-Impfstoffe an die Spitze der Überprüfungslinien. Der Pfizer-Impfstoff wurde nur 21 Tage nach Einreichung überprüft und für den Notfall zugelassen und der Moderna-Impfstoff in nur 19 Tagen (SN: 12.11.20; SN: 18.12.20). Im Vergleich zu einer typischeren Wartezeit von 10 Monaten sind das weitere 283 Tage eingespart.
Insgesamt sind das 1.437 Tage oder 3,9 Jahre, die den normalen Zeitrahmen für einen neuen Impfstoff abschneiden. Und das schließt andere Zeitersparnisse nicht ein, wie zum Beispiel, die Ethikprüfungen an vorderster Front zu platzieren. Addieren Sie diese eingesparte Zeit zu den 11 Monaten, die tatsächlich gedauert haben, um die ersten COVID-19-Impfstoffe zu erhalten, und es würde sich auf fast fünf Jahre summieren – bemerkenswert nah an den sechs Jahren, die für die Prüfung und Zulassung von Patisiran erforderlich sind.
In einem letzten Geschwindigkeitsschub gaben einige Pharmaunternehmen, unterstützt durch große Impfstoffverträge und Forschungsgelder aus der Operation Warp Speed der US-Regierung, auch Dosen während klinischer Studien heraus, in der Hoffnung, dass die Impfstoffe funktionieren würden. Sobald die Unternehmen eine Notfallgenehmigung hatten, waren sie bereit, Dosen sofort zu versenden.
Jahrzehntelange bisherige Arbeit in Kombination mit einem schnelllebigen Virus, einer öffentlichen Hilfsbereitschaft und dem Wegfall von Wartezeiten trieben die rasante Entwicklung von COVID-19-Impfstoffen voran. Es wurden keine Sicherheitsschritte übersprungen, sagt Stanley Plotkin, emeritierter Professor für Pädiatrie an der University of Pennsylvania, der vielleicht am besten für seine Arbeit an der Entwicklung des Röteln-Impfstoffs bekannt ist.
Die schnelle Entwicklung der COVID-19-Impfstoffe, sagt Plotkin, ist „eine grundlegende Veränderung in der Entwicklung von Impfstoffen“. Sie sind ein Beispiel dafür, was Wissenschaftler tun können, wenn sie nicht warten müssen.


