Alzheimer-Patienten in ganz Amerika wird diese Woche ein Funken Hoffnung gegeben, da die Gesundheitsbehörden bereit sind, ein bahnbrechendes Medikament zu genehmigen.
Die Zulassung der monoklonalen Antikörpertherapie Lecanemab durch die Food and Drug Administration (FDA) wird für diesen Donnerstag, den 6. Juli, erwartet.
In klinischen Studien wurde gezeigt, dass das intravenös verabreichte Medikament die toxische Bildung von Klumpen toxischer Amyloidproteine im Gehirn, ein Kennzeichen der Alzheimer-Krankheit, reduziert und die Symptome der grausamen Gedächtnisstörung bei Patienten mit einer frühen Form verlangsamt die Krankheitsdauer um etwa ein Viertel, was in realen Zahlen einer Verlängerung um etwa sechs Monate gesundes Leben entspricht.
Die Zulassung des Demenzmedikaments Leqembi ist so gut wie gesichert, nachdem ein FDA-Gremium letzten Monat einstimmig dafür gestimmt hat, das Medikament Patienten in einem frühen Stadium ihrer Krankheitsprogression zugänglich zu machen
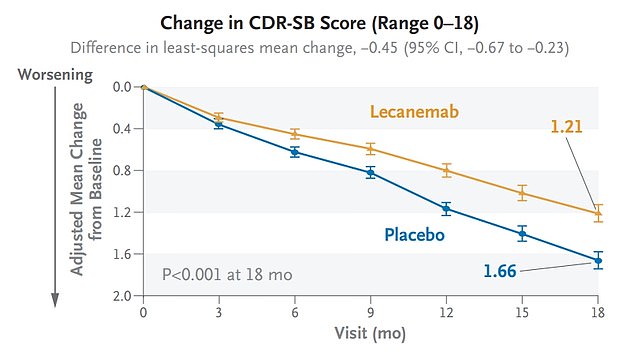
In klinischen Studien zeigte Lecanemab (orange) die Fähigkeit, den kognitiven Rückgang im Vergleich zu Placebo um 27 Prozent zu verlangsamen
Obwohl die Behandlung vielversprechend ist, kann sie schwere und manchmal lebensbedrohliche Nebenwirkungen wie Blutungen oder Schwellungen im Gehirn verursachen.
Doch das Neurologen-Expertengremium der FDA war sich einig, dass die Vorteile des Medikaments das geringe Risiko negativer Reaktionen überwiegen, von denen jeder siebte Studienteilnehmer betroffen war.
Die Zulassung ebnet den Weg für über eine Million Amerikaner im Frühstadium der Krankheit, Zugang zur Alzheimer-Behandlung zu erhalten, die möglicherweise schon am Ende des Sommers beginnen kann.
Um sich für die Behandlung zu qualifizieren, müssen sich potenzielle Patienten Tests unterziehen, die zeigen, dass sie sich in einem frühen Stadium der Demenz befinden.
Ärzte müssen auch feststellen, dass das Gehirn des Patienten Amyloidablagerungen enthält, typischerweise durch eine PET-Untersuchung.
Das Potenzial für das Medikament ist enorm – Schätzungen zufolge leiden mehr als sechs Millionen Amerikaner an der Alzheimer-Krankheit, und von dieser Gesamtzahl leiden zwischen 360.000 und 640.000 an Alzheimer im Frühstadium.
Die Arzneimittelhersteller gehen davon aus, dass aufgrund von Hürden bei der Krankenversicherung weitaus weniger Menschen – 100.000 bis 2026 – das Medikament tatsächlich erhalten werden.
Die tatsächliche Zahl der Patienten, die Zugang dazu erhalten, ist unklar, da die Anbieter bei der Ausgabe mit einem Berg an Papierkram und bürokratischen Hürden zu kämpfen haben.
Es ist auch geplant, es mehr als einer Million Alzheimer-Patienten zur Verfügung zu stellen, die bei Medicare registriert sind. das staatliche Krankenversicherungsprogramm, das sich an Senioren ab 65 Jahren richtet.
Während Medicare erklärt hat, dass es die Rechnung für die Medikamente im Wert von 26.500 US-Dollar pro Jahr „in geeigneten Rahmen“ übernehmen wird, übernimmt Medicare häufig nicht die Nebenkosten für Alzheimer-Behandlungen, die sich auf Tausende von US-Dollar summieren können.
Patienten, die bei Medicare eingeschrieben sind, müssen möglicherweise immer noch einen Anteil an den Kosten für PET-Scans zur Erkennung von Amyloidablagerungen sowie für wiederholte MRTs zahlen, was durchschnittlich 5.000 US-Dollar zusätzlich pro Jahr bedeutet. Dies würde eine große Hürde für Medicare-Teilnehmer darstellen, deren Durchschnittseinkommen bei etwa 31.000 US-Dollar liegt.
An der klinischen Studie im Spätstadium nahmen fast 1.800 Patienten im Alter von 50 bis 90 Jahren mit leichter kognitiver Beeinträchtigung durch Alzheimer oder Alzheimer im Frühstadium teil.
Die Teilnehmer wurden in mehreren Bereichen bewertet, um die Rate des kognitiven Rückgangs zu bestimmen, einschließlich Gedächtnis und Problemlösung. Der kognitive Rückgang wurde mithilfe der klinischen Demenzbewertung gemessen, einer 18-Punkte-Skala, wobei ein höherer Wert auf ein höheres Maß an Beeinträchtigung hinweist.
Der zweimal monatlich verabreichte intravenöse monoklonale Antikörper verlangsamte die Rate des kognitiven Rückgangs um 27 Prozent, was einer Verlangsamung von etwa sechs Monaten entspricht.
Das Medikament erhielt im Januar eine beschleunigte Zulassung von der FDA aufgrund seiner Fähigkeit, klebrige Amyloid-Plaques aus dem Gehirn zu entfernen.
Mehr als 6 Millionen Amerikaner leiden an der Alzheimer-Krankheit, und die überwiegende Mehrheit von ihnen ist über 65 Jahre alt und hat Anspruch auf eine staatliche Krankenversicherung im Rahmen von Medicare.
Bei gesunden Menschen werden diese Amyloidproteine aus dem Gehirn entfernt. Im Zusammenhang mit der Alzheimer-Krankheit sammeln sich die Amyloid-Beta-Proteinablagerungen mit der Zeit an und bilden „klebrige“ Plaques im Gehirn, von denen man annimmt, dass sie die Kommunikation zwischen den Zellen stören und das Immunsystem aktivieren, was zu Entzündungen führt.
Wenn die Ansammlung von Amyloid im Gehirn einen Wendepunkt erreicht, kommt es zur Bildung von Knäueln eines Proteins namens Tau.
Die Bildung dieser Knäuel stört die normale Funktion der Gehirnzellen, indem sie den Transport essentieller Moleküle wie Neurotransmitter, die an der interzellulären Kommunikation beteiligt sind, und Nährstoffen wie Glukose und Sauerstoff stört.
Die Erforschung der genauen Mechanismen, die die Alzheimer-Krankheit verursachen, ist noch nicht abgeschlossen und noch lange nicht abgeschlossen. Einige Forscher glauben, dass Tau beim Fortschreiten der Krankheit eine größere Rolle spielt als Amyloid-Plaques.
Im Laufe der Zeit schädigt die Bildung von Plaques und Tau-Verwicklungen die Synapsen in kritischen Regionen des Gehirns wie beispielsweise dem Hippocampus, der für die Bildung von Erinnerungen von entscheidender Bedeutung ist, sowie des entorhinalen Kortex, der sensorische Informationen aus der äußeren Hirnrinde weiterleitet zum Hippocampus.
Diese Ablagerungen schädigen auch den Parietallappen des Gehirns, der eng mit der Sinneswahrnehmung, dem räumlichen Bewusstsein und der Fähigkeit, die Aufmerksamkeit aufrechtzuerhalten, verbunden ist.
Trotz der vielversprechenden Ergebnisse der Studien sind einige Experten vom Nutzen des Medikaments nicht überzeugt. Während ein Mitglied des Gremiums, Dr. Merit Cudkowicz, die klinischen Beweise als „sehr klar“ und „sehr belastbar“ bezeichnete, äußerten andere Bedenken hinsichtlich der erheblichen Gesundheitsrisiken, die mit dem im Labor hergestellten Antikörper verbunden sind.
Unter denen, die in der Studie Lecanemab erhielten, hatten 17 Prozent eine Gehirnblutung, verglichen mit neun Prozent in der Placebogruppe, und 13 Prozent hatten eine Gehirnschwellung, verglichen mit nur zwei Prozent derjenigen, die ein Placebo erhielten.
In einer früheren Studie brachen etwa sieben Prozent der Studienteilnehmer die Studie aufgrund von Nebenwirkungen ab, verglichen mit weniger als drei Prozent der Placebo-Empfänger.
Insgesamt erlitten 14 Prozent der Personen, die das Medikament erhielten, in der Studie eine schwerwiegende Nebenwirkung, verglichen mit nur 11 Prozent derjenigen, die das Medikament nicht erhielten.
Die Unternehmen, die hinter dem Medikament stehen, Eisai in Tokio und Biogen in Cambridge, Massachusetts, gaben an, dass 13 Studienteilnehmer gestorben seien.
Eine dieser Teilnehmerinnen war die aus Florida stammende Genevieve Lane, 79, die im September 2022, nur eine Woche nach ihrer dritten Dosis des Medikaments, einen massiven, tödlichen Anfall erlitt, der durch ein geplatztes Blutgefäß in ihrem Gehirn ausgelöst wurde.
Frau Lanes Tochter Julie sagte, ihre Mutter befinde sich im Frühstadium ihrer Krankheit und sei für die Lecanemab-Studie geeignet.

Genevieve Lane, abgebildet mit ihren Töchtern, starb im September 2022 nach ihrer dritten Dosis des Alzheimer-Wundermittels Lecanemab
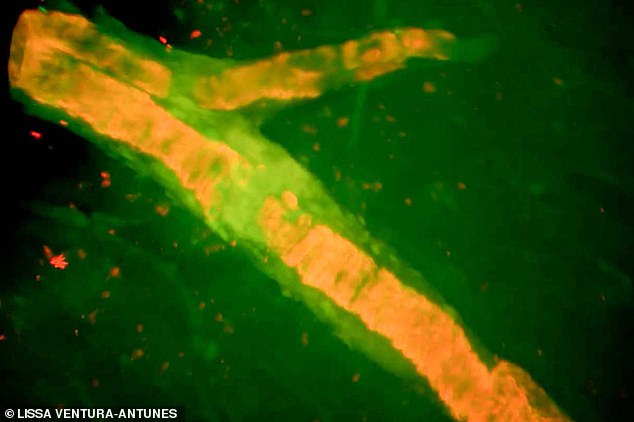
Frau Lane erlitt eine massive Gehirnblutung, wie hier auf diesem Scan zu sehen ist
Doch kurz nach ihrer ersten Infusion verschlechterte sich Genevieves Gesundheitszustand zunächst langsam, dann schnell. Eine Woche nach der dritten Infusion am 7. September brach sie zusammen und wurde ins Krankenhaus eingeliefert, aber die Ärzte konnten wenig tun.
Fünf Tage nach ihrer Aufnahme beschloss die Familie, Genevieves Lebenserhaltungssysteme zu entfernen. Sie starb am 19. September.
Während Neurologen sagen, dass das Medikament für Millionen Amerikaner enorm vielversprechend ist, wird seine Einführung voraussichtlich durch bürokratische Hindernisse ins Stocken geraten. Gemäß den Bundesrichtlinien müssen Ärzte an Registern teilnehmen, die Beweise darüber sammeln, wie die Medikamente in der realen Welt wirken.
Viele Ärzte empfinden diese Anforderung nicht als belastend – das Sammeln von Patientendaten gehört für sie zum Alltag.
Aber Alzheimer-Aktivisten befürchten, dass dies zu schädlichen Verzögerungen bei der Verschreibung führen und einigen Patienten die dringend benötigte Hilfe entziehen wird. Und bei Lecanemab, das für Menschen bestimmt ist, die frühe Anzeichen der Krankheit zeigen, ist Zeit von entscheidender Bedeutung.
Die Genehmigung erfordert außerdem eine Flut von Papierkram, die Kommunikation mit Versicherern und der Regierung sowie die Einstellung qualifizierter Arbeitskräfte für die Diagnose und Behandlung von Alzheimer. Eine immer älter werdende Bevölkerung geht mit einem Anstieg der Alzheimer- und verwandten Formen der Demenz einher, und das Gesundheitssystem muss mit der Entwicklung Schritt halten.