Eine Studie hat ergeben, dass das SARS-CoV-2-Virus bis zu 18 Monate nach der Infektion in der Lunge verbleiben kann, was die Annahme widerlegt, dass es nach der ersten Genesung nicht mehr nachweisbar ist. Diese Persistenz hängt mit einem Versagen des angeborenen Immunsystems zusammen. Die Forschung, die die Existenz von „Virusreservoirs“ ähnlich denen bei HIV bestätigt, unterstreicht die Rolle von NK-Zellen bei der Kontrolle dieser Reservoirs. Diese Entdeckung ist entscheidend für das Verständnis von Long-COVID und den Mechanismen der Viruspersistenz.
Das zeigt eine bahnbrechende Studie SARS-CoV-2 kann monatelang in der Lunge verweilen, sich der Entdeckung entziehen und aufgrund von Fehlern im angeborenen Immunsystem möglicherweise zu einer langen COVID-Erkrankung führen.
Ein bis zwei Wochen nach der Ansteckung mit COVID, dem SARS-CoV-2 Virus in den oberen Atemwegen im Allgemeinen nicht mehr nachweisbar. Aber bedeutet das, dass es nicht mehr im Körper vorhanden ist? Um das herauszufinden, führte ein auf HIV spezialisiertes Team des Institut Pasteur in Zusammenarbeit mit einem französischen öffentlichen Forschungsinstitut, der Kommission für alternative Energien und Atomenergie (CEA), eine Studie an Lungenzellen in einem Tiermodell durch. Die Ergebnisse zeigen nicht nur, dass SARS-CoV-2 bis zu 18 Monate nach der Infektion in der Lunge bestimmter Personen nachweisbar ist, sondern auch, dass seine Persistenz offenbar mit einem Versagen der angeborenen Immunität (der ersten Verteidigungslinie gegen Krankheitserreger) zusammenhängt ). Diese Forschung wurde in der Zeitschrift veröffentlicht Naturimmunologie.
Entdeckung viraler Reservoire in COVID-19
Einige Viren bleiben nach der Auslösung einer Infektion diskret und nicht nachweisbar im Körper bestehen. Sie verbleiben in sogenannten „Virusreservoirs“. Dies ist bei HIV der Fall, das in bestimmten Immunzellen latent bleibt und jederzeit reaktivieren kann. Dies könnte auch auf das SARS-CoV-2-Virus zutreffen, das die Krankheit verursacht COVID 19. Zumindest ist das die Hypothese, die ein Team von Wissenschaftlern des Institut Pasteur im Jahr 2021 aufgestellt hat und die nun in einem präklinischen Modell eines nichtmenschlichen Primaten bestätigt wurde.
„Wir haben beobachtet, dass die Entzündung bei Primaten, die mit SARS-CoV-2 infiziert waren, über lange Zeiträume anhielt. Wir vermuteten daher, dass es an der Anwesenheit des Virus im Körper liegen könnte“, erklärt Michaela Müller-Trutwin, Leiterin der Abteilung HIV, Entzündung und Persistenz des Institut Pasteur.
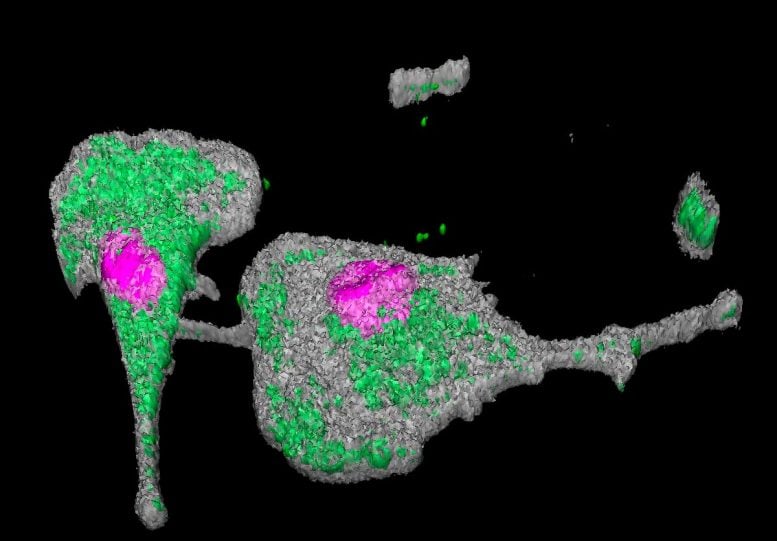
Die Studie zeigte, dass das SARS-CoV-2-Virus über brückenartige Zellfortsätze von einem Makrophagen auf einen anderen übertragen wird und sich so ausbreiten kann. Der Zellkern ist rosa hervorgehoben und das virale Protein NSP3 ist grün hervorgehoben. Bildnachweis: © Marie Lazzerini, Nicolas Huot, Institut Pasteur
Studienergebnisse
Um die Persistenz des SARS-CoV-2-Virus zu untersuchen, analysierten Wissenschaftler des Institut Pasteur in Zusammenarbeit mit dem IDMIT-Zentrum (Infectious Disease Models for Innovative Therapies) der CEA biologische Proben von Tiermodellen, die mit dem Virus infiziert waren. Erste Ergebnisse der Studie deuten darauf hin, dass bei einigen Personen 6 bis 18 Monate nach der Infektion Viren in der Lunge gefunden wurden, obwohl das Virus in den oberen Atemwegen oder im Blut nicht nachweisbar war. Ein weiteres Ergebnis war, dass die Menge des persistierenden Virus in der Lunge beim Omicron-Stamm geringer war als beim ursprünglichen SARS-CoV-2-Stamm.
„Wir waren wirklich überrascht, nach so langer Zeit und als regelmäßige PCR-Tests negativ waren, Viren in bestimmten Immunzellen – Alveolarmakrophagen – zu finden“, betont Nicolas Huot, Erstautor der Studie und Forscher am Institut Pasteur für HIV, Entzündung und Persistenzeinheit. „Darüber hinaus haben wir diese Viren kultiviert und konnten mit den von uns zur Untersuchung von HIV entwickelten Werkzeugen beobachten, dass sie sich immer noch vermehren konnten.“
Um die Rolle der angeborenen Immunität bei der Kontrolle dieser Virusreservoirs zu verstehen, richteten die Wissenschaftler ihre Aufmerksamkeit dann auf NK-Zellen (natürliche Killerzellen). „Die zelluläre Reaktion der angeborenen Immunität, die die erste Verteidigungslinie des Körpers darstellt, ist bei SARS-CoV-2-Infektionen bisher wenig untersucht“, sagt Michaela Müller-Trutwin. „Aber es ist schon lange bekannt, dass NK-Zellen eine wichtige Rolle bei der Kontrolle viraler Infektionen spielen.“ Die Studie zeigt, dass bei einigen Tieren mit SARS-CoV-2 infizierte Makrophagen resistent gegen die Zerstörung durch NK-Zellen werden, während bei anderen NK-Zellen in der Lage sind, sich an eine Infektion anzupassen (sogenannte adaptive NK-Zellen) und dabei resistente Zellen zu zerstören Fall Makrophagen.
Die Studie hat daher Licht auf einen Mechanismus geworfen, der das Vorhandensein von „Virusreservoirs“ erklären könnte: Während Personen mit wenig oder keinem langfristigen Virus eine adaptive NK-Zellenproduktion aufwiesen, fehlten bei Personen mit höheren Viruskonzentrationen nicht nur adaptive NK Zellen, sondern auch eine Verringerung der NK-Zellaktivität. Die angeborene Immunität scheint daher eine Rolle bei der Bekämpfung persistierender SARS-CoV-2-Viren zu spielen.
Zukünftige Forschungsrichtungen
„Wir werden mit einer Studie einer Kohorte beginnen, die zu Beginn der Pandemie mit SARS-CoV-2 infiziert war, um herauszufinden, ob die identifizierten Virusreservoirs und Mechanismen mit Fällen von Long-COVID zusammenhängen. Aber die Ergebnisse hier stellen bereits einen wichtigen Schritt zum Verständnis der Natur von Virusreservoirs und der Mechanismen dar, die die Viruspersistenz regulieren“, sagt Michaela Müller-Trutwin.
Referenz: „Die Viruspersistenz von SARS-CoV-2 in Lungenalveolarmakrophagen wird durch IFN-γ- und NK-Zellen kontrolliert“ von Nicolas Huot, Cyril Planchais, Pierre Rosenbaum, Vanessa Contreras, Beatrice Jacquelin, Caroline Petitdemange, Marie Lazzerini, Emma Beaumont, Aurelio Orta-Resendiz, Félix A. Rey, R. Keith Reeves, Roger Le Grand, Hugo Mouquet und Michaela Müller-Trutwin, 2. November 2023, Naturimmunologie.
DOI: 10.1038/s41590-023-01661-4
Diese Forschung wurde hauptsächlich von einer Familie von Großspendern im Rahmen der Projektausschreibung des COVID-Forschungsprogramms finanziert.

