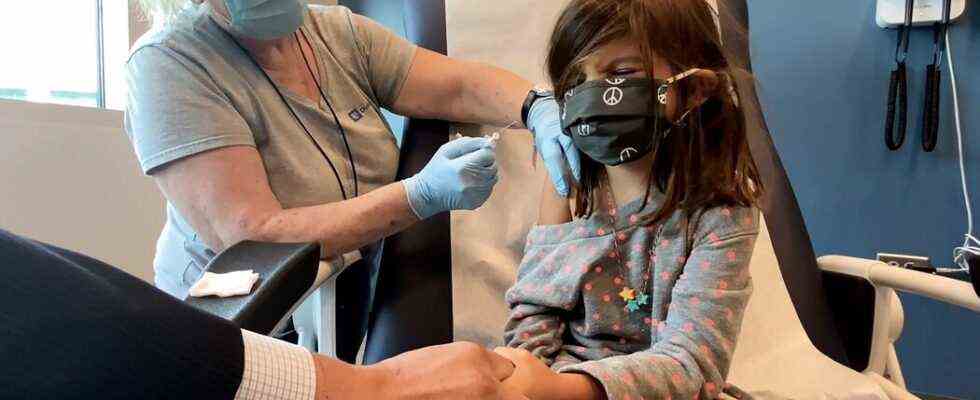
WASHINGTON – Bundesaufsichtsbehörden bewerteten am Freitag zum ersten Mal die Sicherheit und Wirksamkeit eines Coronavirus-Impfstoffs für Kinder zwischen 5 und 11 Jahren und sagten, dass die Vorteile der Abwehr von Covid-19 mit dem Pfizer-BioNTech-Impfstoff im Allgemeinen die Risiken des besorgniserregendsten überwiegen Nebenwirkungen in dieser Altersgruppe.
Die Analyse erfolgte am selben Tag, an dem die Food and Drug Administration Daten von Pfizer veröffentlichte, die zeigten, dass der Impfstoff in einer klinischen Studie mit 5- bis 11-Jährigen eine Wirksamkeitsrate von 90,7 Prozent bei der Vorbeugung von symptomatischem Covid-19 aufwies.
Die Ergebnisse könnten der FDA-Zulassung der pädiatrischen Dosis im Notfall, vielleicht schon nächste Woche, Impulse verleihen und eine lang erwartete neue Phase der landesweiten Impfkampagne einleiten. Der unabhängige Expertenausschuss für Impfstoffe der Agentur wird am Dienstag darüber abstimmen, ob eine Zulassung empfohlen wird.
In einem auf der FDA-Website veröffentlichten Informationsdokument sagte die Agentur, sie habe die Gefahren eines Krankenhausaufenthalts, des Todes oder anderer schwerwiegender Folgen von Covid-19 gegen das Risiko einer Myokarditis abgewogen. Myokarditis, eine seltene Erkrankung mit Herzmuskelentzündung, wurde insbesondere bei jungen Männern mit den Impfstoffen Pfizer-BioNTech und Moderna in Verbindung gebracht.
„Die Gesamtanalyse prognostizierte, dass die Zahl der verhinderten klinisch signifikanten Covid-19-bezogenen Ergebnisse die Zahl der impfassoziierten Myokarditis-Fälle deutlich überwiegen würde“, schrieben die Aufsichtsbehörden.
Wie üblich vor einer Abstimmung des Beratungsausschusses der FDA nahmen die Aufsichtsbehörden keine Stellung dazu, ob die neue Verwendung eines Impfstoffs zugelassen werden sollte.
Wenn die FDA für die Zulassung entscheidet und die Centers for Disease Control and Prevention und ihr eigenes Gremium von Impfstoffexperten zustimmen, könnten die 28 Millionen Kinder in dieser Altersgruppe in der ersten Novemberwoche für Impfungen in Frage kommen.
„Es gibt viele Daten, auf die man sich stützen kann“, sagte Dr. Kathryn M. Edwards, Professorin für Pädiatrie in der Abteilung für Infektionskrankheiten an der medizinischen Fakultät der Vanderbilt University. Sie sagte, die Ergebnisse übertrafen den Schutz, den der beste Grippeimpfstoff bietet, und könnten schließlich zu einer Lockerung der Beschränkungen führen, die verhindern sollen, dass Grundschulkinder sich mit dem Virus infizieren.
Die Regierung von Biden hat eifrig die Aussicht auf eine pädiatrische Impfung gefördert, und viele Eltern warten gespannt auf die Entwicklung. Covid-19-Fälle bei Personen unter 18 Jahren erreichten in der ersten Septemberwoche ihren Höhepunkt, als fast eine Viertelmillion Fälle gemeldet wurden.
Aber sie sind hoch geblieben, mit mehr als 130.000 gemeldeten Fällen in der zweiten Oktoberwoche, sagte die American Academy of Pediatrics, was ein Viertel aller landesweiten Fälle ausmacht. Weniger als zwei Prozent dieser Fälle führten zu einer Krankenhauseinweisung, aber diese Zahl basierte auf Daten aus nur der Hälfte der Bundesstaaten, sagte die Organisation.
Pfizer und BioNTech gaben vor einem Monat bekannt, dass ihr Impfstoff bei kleinen Kindern gut funktioniert, aber bis Freitag wurden keine umfassenden klinischen Daten veröffentlicht. Kinder in der Studie erhielten zwei Dosen von 10 Mikrogramm – ein Drittel der Erwachsenendosis – im Abstand von drei Wochen. Die Forscher sagten, dass die Dosierung sicher war und dass die Studienteilnehmer nur leichte Nebenwirkungen gesehen hatten.
Von 2.268 Kindern in der Studie erhielten doppelt so viele den Impfstoff wie ein Placebo. Sechzehn Kinder, die das Placebo erhielten, bekamen Covid-19, verglichen mit drei, die den Impfstoff erhielten. Alle Covid-Fälle traten im Juli oder später auf, als sich die hoch übertragbare Delta-Variante nach Angaben des Unternehmens in den USA und weltweit verbreitete. Die FDA sagte, sie könne nicht feststellen, ob die Fälle durch die Delta-Variante verursacht wurden.
Pfizer sagte, es lägen weitere Sicherheitsdaten für weitere 2.250 Kinder vor, jedoch nur für einen Median von zweieinhalb Wochen, nachdem sie eine zweite Dosis erhalten hatten.
Es gab keine Fälle von schwerem Covid unter den Studienteilnehmern und keine Fälle von zwei seltenen Herzerkrankungen, die bei Jugendlichen und Erwachsenen, insbesondere jungen Männern, mit dem Impfstoff in Verbindung gebracht wurden. Aber die Studie war wahrscheinlich nicht groß genug, um festzustellen, ob diese besonderen Erkrankungen – Myokarditis und Perikarditis – bei jüngeren Kindern mit irgendeiner Häufigkeit auftreten könnten.
Leichte Nebenwirkungen traten in der Studiengruppe im Allgemeinen nach der zweiten Dosis häufiger auf, berichtete die FDA; am häufigsten waren Schmerzen an der Injektionsstelle, Müdigkeit und Kopfschmerzen.
Die FDA modellierte verschiedene Szenarien mit unterschiedlicher Virusausbreitung, um die Anzahl der symptomatischen Covid-Fälle, einschließlich schwerer, zu bestimmen, die durch den Impfstoff verhindert würden. Sie balancierten dies gegen die Risiken von Myokarditis- und Perikarditis-Fällen im Zusammenhang mit Impfungen.
Selbst bei einer geringen Covid-Infektionsrate könnten die Vorteile der Impfung die Risiken überwiegen, da das Virus zu schwerwiegenderen gesundheitlichen Folgen führen könnte als Nebenwirkungen.
Die Forscher untersuchten die Immunantworten und verglichen sie mit den Werten bei Erwachsenen, die den Impfstoff erhalten hatten. Pfizer folgerte dann, dass der Schutz, den die niedrigere Dosis bei Kindern bietet, genauso groß sein könnte wie der der höheren Dosis bei Erwachsenen. Dieser Ansatz ist besonders bei kleinen Studien wichtig.
Nach dem zweiten Schuss hatten die Kinder neutralisierende Antikörper, die mindestens denen von 16- bis 25-jährigen Freiwilligen in einer anderen Pfizer-BioNTech-Studie entsprachen. Obwohl Antikörperspiegel nur ein Maß für die Reaktion des Immunsystems sind, sagten Experten, dass ein solches Ergebnis darauf hindeutet, dass ein Drittel einer Erwachsenendosis die richtige Dosis für kleine Kinder ist.
Was Sie über Covid-19 Booster Shots wissen sollten
Die FDA hat Millionen von Empfängern der Pfizer-BioNTech-, Moderna- und Johnson & Johnson-Impfstoffe eine Auffrischimpfung genehmigt. Zu den Empfängern von Pfizer und Moderna, die Anspruch auf eine Auffrischung haben, gehören Personen ab 65 Jahren und jüngere Erwachsene, die aufgrund von Erkrankungen oder ihres Arbeitsplatzes einem hohen Risiko für schweres Covid-19 ausgesetzt sind. Berechtigte Pfizer- und Moderna-Empfänger können mindestens sechs Monate nach ihrer zweiten Dosis eine Auffrischimpfung erhalten. Alle Empfänger von Johnson & Johnson haben Anspruch auf eine zweite Aufnahme mindestens zwei Monate nach der ersten.
Jawohl. Die FDA hat ihre Zulassungen aktualisiert, um es medizinischen Anbietern zu ermöglichen, Menschen mit einem anderen Impfstoff als dem, den sie ursprünglich erhalten haben, aufzufrischen, eine Strategie, die als “Mix and Match” bekannt ist. Unabhängig davon, ob Sie Moderna, Johnson & Johnson oder Pfizer-BioNTech erhalten haben, können Sie eine Auffrischimpfung mit jedem anderen Impfstoff erhalten. Die Aufsichtsbehörden haben keinen Impfstoff gegenüber einem anderen als Auffrischungsimpfung empfohlen. Sie haben auch darüber geschwiegen, ob es vorzuziehen ist, nach Möglichkeit beim gleichen Impfstoff zu bleiben.
Die CDC hat gesagt, dass die Bedingungen, die eine Person für eine Auffrischimpfung qualifizieren, umfassen: Bluthochdruck und Herzerkrankungen; Diabetes oder Fettleibigkeit; Krebs oder Blutkrankheiten; geschwächtes Immunsystem; chronische Lungen-, Nieren- oder Lebererkrankung; Demenz und bestimmten Behinderungen. Schwangere Frauen sowie aktuelle und ehemalige Raucher sind ebenfalls förderfähig.
Die FDA hat Booster für Arbeitnehmer zugelassen, deren Arbeit sie einem hohen Risiko aussetzt, potenziell infektiösen Personen ausgesetzt zu werden. Die CDC sagt, dass diese Gruppe umfasst: medizinisches Notfallpersonal; Bildungsarbeiter; Lebensmittel- und Landwirtschaftsarbeiter; Fertigungsarbeiter; Korrektur Arbeiter; Mitarbeiter des US-Postdienstes; Mitarbeiter des öffentlichen Nahverkehrs; Mitarbeiter von Lebensmittelgeschäften.
Jawohl. Die CDC sagt, dass der Covid-Impfstoff ohne Rücksicht auf den Zeitpunkt anderer Impfstoffe verabreicht werden kann, und viele Apotheken ermöglichen es den Menschen, eine Grippeimpfung gleichzeitig mit einer Auffrischungsdosis zu planen.
Studien haben gezeigt, dass das Risiko, durch Covid-19 eine Myokarditis oder Perikarditis zu entwickeln, höher ist als durch eine Impfung. Dennoch haben einige Länder eine Einzeldosis des Pfizer-BioNTech-Impfstoffs für Kinder ab 12 Jahren empfohlen, die weniger Schutz bietet, aber möglicherweise mit einem geringeren Risiko für Nebenwirkungen.
Laut Dr. H. Cody Meissner, Mitglied des Gremiums und Leiter der Abteilung für pädiatrische Infektionskrankheiten am Tufts Children’s Hospital in Boston, werden Experten bei der Sitzung des FDA-Beratungsausschusses mit ziemlicher Sicherheit Bedenken hinsichtlich dieser Nebenwirkungen äußern.
„Ich hoffe auf jeden Fall, dass wir in der Lage sind, dies zu empfehlen, weil die Leute sicherlich darauf warten, sie wollen es unbedingt haben“, sagte er. „Aber unsere Verantwortung besteht darin, Risiko und Nutzen abzuwägen.“
Impfstoffexperten haben gesagt, dass die niedrigere Dosierung von Pfizer die Risiken mindern könnte. „Wir verwenden immer gerne die geringste Menge an Impfstoff, die benötigt wird, um eine Immunantwort hervorzurufen“, sagte Dr. Edwards, der Vanderbilt-Experte, „weil dies im Allgemeinen mit weniger unerwünschten Ereignissen verbunden ist.“
Dr. Brian Feingold, Experte für Herzentzündungen bei Kindern am UPMC Children’s Hospital in Pittsburgh, sagte: „Wenn Sie sich nur auf Myokarditis oder andere potenziell seltene Dinge konzentrieren, werden Sie wahrscheinlich immer noch weitere Informationen wünschen.“
Aber „wir können ein Risiko nicht isoliert betrachten“, fügte er hinzu. “Risiken durch Covid müssen berücksichtigt werden, wenn Sie eine Entscheidung darüber treffen, ob dieser Impfstoff einen größeren Nettonutzen hat.”
Dr. Edwards sagte, dass sich Forscher und Aufsichtsbehörden in einer Zwickmühle befanden. „Je mehr Leute Sie einschreiben, desto länger dauert es“, sagte sie. „Um die Daten für sehr seltene Ereignisse wirklich zu betrachten, ist dies in Studien oft nicht möglich, bis der Impfstoff wirklich breiter eingesetzt wird.“
Die Zentren für die Kontrolle und Prävention von Krankheiten, die die Impfstoffpolitik für die Regierung festlegen, haben für den 2. und 3. November eine Sitzung ihres Beratungsausschusses angesetzt, um das Thema zu erörtern. Bundesbeamte haben angekündigt, sofort 15 Millionen Dosen an die Bundesstaaten zu versenden, wenn die Aufsichts- und Gesundheitsbehörden den Umzug genehmigen. Die Nadeln, die den Impfstoff verabreichen, und die Fläschchen, die ihn enthalten, müssen für Kinder, die noch weitgehend in der Grundschule sind, kleiner sein.
Etwa 17 Millionen Jugendliche im Alter von 12 bis 15 Jahren haben im Mai Anspruch auf den Pfizer-BioNTech-Impfstoff. Impfstoffhersteller prüfen weiterhin die Möglichkeit eines Impfstoffs für Personen im Alter von sechs Monaten bis 5 Jahren.
Laut einer Umfrage der Kaiser Family Foundation vom letzten Monat plante nur etwa jeder dritte Elternteil von 5- bis 11-Jährigen, ihre Kinder “sofort” impfen zu lassen, sobald ein Impfstoff zugelassen ist. Ein weiteres Drittel sagte, sie wolle „abwarten“, wie sich der Impfstoff auf Kinder auswirkt.
Dieselbe Umfrage zeigte jedoch, dass die Zurückhaltung bei den Eltern von Teenagern in den Monaten seit der Verfügbarkeit von Impfstoffen für diese Altersgruppe abgenommen hatte.
Aina J. Khan Berichterstattung aus London beigetragen, und Carl Zimmer aus New Haven, Conn.