Die antivirale COVID-19-Pille von Merck kann laut Studie das Sterberisiko durch das Virus um 30 % senken
- Eine neue antivirale COVID-19-Pille kann das Risiko eines Krankenhausaufenthalts und des Todes durch Covid um 30 % senken, wie eine neue Studie zeigt
- Die Daten wurden am Freitag vor einer FDA-Beratungssitzung nächste Woche veröffentlicht, bei der die Zulassung erörtert wird
- Eine frühere Studie ergab auch, dass das Medikament Krankenhausaufenthalte und Todesfälle durch COVID-19 um 50% reduzieren könnte
- Das Unternehmen arbeitet mit Generikaherstellern zusammen, um die Pillen nach der Zulassung weltweit verfügbar zu machen
Eine neue antivirale COVID-19-Pille, die von Merck & Co entwickelt wurde, kann das Risiko, durch das Virus zu sterben, verringern, wie eine neue Studie zeigt.
Molnupiravir wurde von dem in Kenilworth, New Jersey, ansässigen Pharmaunternehmen entwickelt und kann das Risiko eines Krankenhausaufenthalts oder eines Todesfalls um 30 Prozent senken.
Das Unternehmen strebt derzeit eine Notfallgenehmigung der US-amerikanischen Food and Drug Administration (FDA) an, die nächste Woche von den Beratern der Behörde erörtert wird.
Wenn das in Zusammenarbeit mit Ridgeback Biotherapeutics entwickelte Medikament in den USA die Zulassung erhält – was in Großbritannien bereits geschehen ist -, wird es das erste orale Medikament sein, das zur Behandlung des Virus zugelassen ist.
Eine neue Studie zeigt, dass Molnupiravir (im Bild), eine von Merck entwickelte antivirale Pille, das Risiko eines Krankenhausaufenthalts oder des Todes durch das Virus um 30 % senkt
Die am Freitag von der FDA veröffentlichte Studie umfasste über 1.400 Teilnehmer.
Etwa 700 Teilnehmer, die kürzlich Symptome von Covid verspürten, wurden in eine von zwei Gruppen eingeteilt.
Eine Gruppe erhielt das Medikament, die andere erhielt ein Placebo und wurde als Kontrollgruppe operiert.
Die Forscher fanden heraus, dass 9,7 Prozent der Kontrollgruppe einen schweren Fall erlitten, der einen Krankenhausaufenthalt erforderte oder zum Tod führte – verglichen mit nur 6,8 Prozent der Kontrollgruppe, was einer Reduzierung von 30 Prozent entspricht.
„Merck und Ridgeback Biotherapeutics haben ein rigoroses Entwicklungsprogramm für Molnupiravir durchgeführt und glauben, dass Molnupiravir das Potenzial hat, einen erheblichen ungedeckten medizinischen Bedarf an einem oralen Arzneimittel für Erwachsene mit COVID-19 zu decken, bei denen das Risiko besteht, zu schwerem COVID-19 fortzuschreiten, und /oder Krankenhausaufenthalt“, schrieben Vertreter von Merck in einer Erklärung.
“Wir freuen uns auf die Zusammenarbeit mit der FDA und anderen Behörden bei der Prüfung unserer Anträge.”
Frühere Studien haben noch vielversprechendere Ergebnisse für Molnupiravir gefunden, wobei das Medikament das Krankenhausaufenthaltsrisiko von 14 Prozent auf sieben Prozent halbieren konnte.
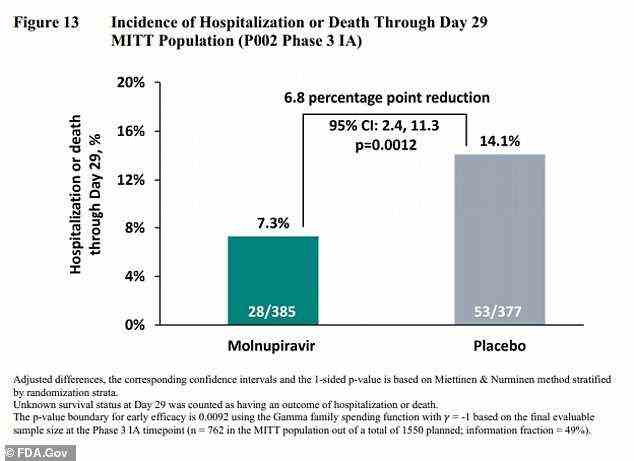
Eine frühere Studie ergab, dass das Medikament Krankenhausaufenthalte und Todesfälle durch Covid halbieren könnte, von einem Risiko von 14,1 % (rechts) auf ein Risiko von 7,3 % (links).
Das Medikament wirkt, indem es die Vermehrung des Virus im Körper blockiert.
Dies geschieht, indem Fehler in den genetischen Code von Covid eingeführt werden, was seine Fähigkeit zur Vermehrung in menschlichen Zellen behindert.
Das Medikament zielt auf ein Enzym ab, auf das das Virus angewiesen ist, um Kopien von sich selbst zu erzeugen. Merck sagte, dass dieser Prozess das Tablet bei der Bekämpfung neuer Varianten gleichermaßen effektiv machen sollte.
Wenn es weltweit die behördliche Zulassung erhält, plant das Unternehmen, mit Generikaherstellern zusammenzuarbeiten, um das Medikament in Entwicklungsländern zu vertreiben.
Im Juli kündigte das Unternehmen an, mit Generikaherstellern mit Sitz in Indien zusammenzuarbeiten, um das Medikament in der von Covid betroffenen Nation allgemein verfügbar zu machen.


Das Unternehmen gab diese Woche auch eine Partnerschaft mit dem Medicines Patent Pool, einer von den Vereinten Nationen unterstützten öffentlichen Gesundheitsorganisation, bekannt, um die Verteilung des Medikaments in über 100 anderen Nationen zu unterstützen.
Wenn das Medikament von den Aufsichtsbehörden genehmigt wird, haben die USA einen Vertrag über die Bestellung von 1,7 Millionen Dosen abgeschlossen.
Die Genehmigung könnte bereits am 30. November kommen.
Frankreich hat auch 50.000 Dosen des Medikaments vor der Zulassung durch die Aufsichtsbehörden bestellt.
Obwohl das Medikament von den EU-Regulierungsbehörden keine vollständige Zulassung erhalten hat, wurde es für die Anwendung bei einigen Covid-Patienten freigegeben, die als besonders hohes Risiko für schwere Komplikationen durch das Virus gelten.
Das in New York ansässige Pharmaunternehmen Pfizer entwickelt auch ein orales antivirales Covid-Medikament, das auch in den USA zugelassen werden soll

