Zusammenfassung: Studie enthüllt einen neuartigen Mechanismus in Neuronen des Locus coeruleus, der durch den Verlust des mitochondrialen Enzyms GPT2 verursacht wird, das an der Entwicklung und dem Fortschreiten neurodegenerativer Erkrankungen beteiligt ist.
Quelle: Universität Brown
Der Locus coeruleus gehört zu den ersten Hirnregionen, die bei Alzheimer und Parkinson degenerieren, wissen Mediziner und Wissenschaftler. Aber warum dieser Bereich so anfällig ist, ist weniger bekannt.
Während sie ihre Erforschung einer seltenen neurogenetischen Störung fortsetzten, entdeckte ein Team von Forschern der Brown University Erklärungen, die Licht auf diese wichtige Frage werfen.
Im Tagebuch Neurobiologie der Krankheitberichten die Forscher über einen neuartigen Degenerationsmechanismus in den Neuronen des Locus coeruleus, der durch den Verlust eines mitochondrialen Enzyms, GPT2, verursacht wird, das an der neurologischen Störung beteiligt ist, auf die sich die Forscher konzentrieren.
„Diese Ergebnisse stellen eine neue Richtung der Forschung zu diesem wirklich wichtigen Teil des Gehirns dar“, sagte Studienautor Dr. Eric Morrow, Professor für Biologie, Neurowissenschaften, Psychiatrie und menschliches Verhalten an der Warren Alpert Medical School und Direktor der Brown University Zentrum für translationale Neurowissenschaften.
Der Locus coeruleus befindet sich im Hirnstamm und ist ein kritischer Bereich, der eine wichtige Quelle von Neuronen beherbergt, die den Neurotransmitter Norepinephrin über Projektionen im gesamten Gehirn bereitstellen. Norepinephrin ist ein übliches Arzneimittelziel für viele Krankheitsbehandlungen, sagte Morrow.
Der Locus coeruleus ist an einer Vielzahl von kognitiven Prozessen wie Aufmerksamkeit, Lernen, Stimmung, Wachheit und Schlaf beteiligt. Der Tod der Neuronen in diesem Teil des Gehirns ist auch an kognitiven Erkrankungen wie Alzheimer und Parkinson beteiligt.
In den letzten Jahren ist der Locus coeruleus zu einem Gebiet von weit verbreitetem und intensivem Forschungsinteresse geworden, sagte Morrow. Doch sein Team war ursprünglich nicht bestrebt, diesen Teil des Gehirns in seinen Experimenten zu untersuchen.
„Das ist eines der Dinge, die diese Entdeckung so aufregend machen“, sagte Morrow. „Dies war ein völlig zufälliger Befund, der ehrlich gesagt hätte übersehen werden können. Dies ist ein Beispiel dafür, wie die Forschung, die sich auf genetische Informationen konzentriert, uns bisher unvorhergesehene Lektionen über das Gehirn beibringen kann.“
Das Team, zu dem auch der Brown-Neurowissenschaftler Ozan Baytas gehörte, hatte untersucht, wie eine bestimmte genetische Mutation an einer seltenen, neurogenetischen Störung namens GPT2-Mangel beteiligt ist – einem genetischen Syndrom, über das das Morrow-Labor erstmals 2016 berichtete.
Das interessierende Gen heißt GPT2 (Glutamat-Pyruvat-Transaminase 2) und erzeugt ein Enzym, das für Stoffwechselwege in den Mitochondrien, den Energiezentren der Zellen, von entscheidender Bedeutung ist.
Nach der Einführung der Mutation in das metabolische Gen in Labormäusen zur Untersuchung des GPT2-Mangels entdeckten die Forscher, dass dieser Verlust des mitochondrialen Enzyms dazu führte, dass der Locus coeruleus relativ früh und selektiv in der Lebensspanne der Maus degenerierte.
Das GPT2-Enzym reguliert das neuronale Wachstum durch die Wiederauffüllung von Zwischenprodukten des Tricarbonsäurezyklus und die Modulation des Aminosäurestoffwechsels.
Bei Mäusen, die das GPT2-Enzym nicht haben, beobachteten die Forscher einen frühen Verlust von Neuronen im Locus coeruleus sowie andere Anzeichen von Degeneration, wie zum Beispiel einen Mangel an Proteinsynthese und verkümmertes Zellwachstum.
Ein spezifischer Teil der Arbeit betraf die Elektrophysiologie von Neuronen. Diese Experimente wurden im Labor der Co-Autorin Julie Kauer durchgeführt, damals bei Brown und jetzt Professorin für Psychiatrie und Verhaltenswissenschaften an der Stanford University.
„Unsere Ergebnisse deuten darauf hin, dass ein veränderter Stoffwechsel die anfängliche treibende Kraft für die Neurodegeneration im Locus coeruleus sein könnte“, sagte der Hauptautor der Studie, Baytas.
„Das Auffinden der genauen Ursachen dieser Degeneration kann uns über die Krankheitsmechanismen im Locus coeruleus informieren, die wir korrigieren oder besser noch verhindern können, um Demenz und damit verbundene Verhaltensstörungen zu stoppen.
„Die Ergebnisse in unserem Mausmodell einer neurometabolischen Erkrankung eröffnen einen neuen Ausblick auf die Neurodegeneration des Locus coeruleus und ermutigen zu weiterer Forschung zur metabolischen Anfälligkeit dieser Neuronen.“
Aufgrund des Fokus auf den Locus coeruleus bei der Entwicklung von Medikamentenbehandlungen, sagte Morrow, wird diese Erkenntnis über die frühe Beeinträchtigung dieser Gehirnregion für ein breites Spektrum von Menschen in der neurowissenschaftlichen und neuropsychiatrischen Gemeinschaft von Interesse sein.
Die Hoffnung, fügte er hinzu, sei, dass diese Studien schließlich zu therapeutischen Zielen für die Alzheimer-Krankheit und andere neurodegenerative Erkrankungen führen werden.
Über diese Neuigkeiten aus der Neurodegenerationsforschung
Autor: Pressebüro
Quelle: Universität Brown
Kontakt: Pressestelle – Brown University
Bild: Das Bild wird der Brown University zugeschrieben
Siehe auch

Ursprüngliche Forschung: Uneingeschränkter Zugang.
„Der Verlust des mitochondrialen Enzyms GPT2 verursacht eine frühe Neurodegeneration im Locus coeruleus“ von Ozan Baytas et al. Neurobiologie der Krankheit
Abstrakt
Der Verlust des mitochondrialen Enzyms GPT2 verursacht eine frühe Neurodegeneration im Locus coeruleus
Locus coeruleus (LC) gehört zu den ersten Hirnarealen, die bei der Alzheimer-Krankheit und der Parkinson-Krankheit degenerieren; Die zugrunde liegenden Ursachen für die Anfälligkeit von LC-Neuronen sind jedoch nicht gut definiert.
Hier berichten wir über einen neuartigen Mechanismus der Degeneration von LC-Neuronen, der durch den Verlust des mitochondrialen Enzyms Glutamat-Pyruvat-Transaminase 2 (GPT2) verursacht wird. GPT2-Mangel ist eine neu erkannte neurometabolische Störung im Kindesalter.
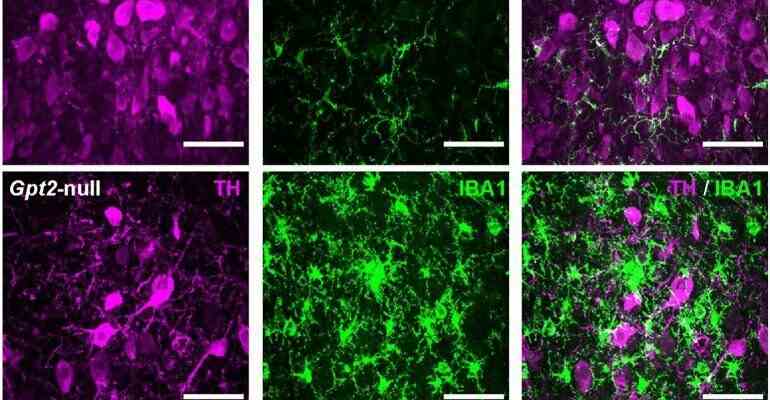
Das GPT2-Enzym reguliert das Zellwachstum durch Auffüllen von Tricarbonsäure (TCA)-Zyklus-Zwischenprodukten und Modulation des Aminosäurestoffwechsels. Im Gpt2-null-Mäuse beobachten wir einen frühen Verlust von Tyrosinhydroxylase (TH)-positiven Neuronen in LC und eine reduzierte Somagröße am postnatalen Tag 18. Gpt2-null LC zeigt eine selektive positive Fluoro-Jade C-Färbung.
Neuronenverlust wird von selektiver, prominenter Mikrogliose und Astrogliose bei LC begleitet. Wir beobachten reduzierte noradrenerge Projektionen auf und Norepinephrinspiegel im Hippocampus und im Rückenmark.
Ganzzellaufnahmen in Gpt2-Null-LC-Scheiben zeigen eine reduzierte Somagröße und abnormale Aktionspotentiale mit veränderter Feuerungskinetik. Auffallenderweise beobachten wir eine frühe Abnahme des phosphorylierten S6 in Gpt2-null LC, vorausgehende prominente p62-Aggregation, erhöhtes Verhältnis von LC3B-II zu LC3B-I und neuronaler Verlust.
Diese Daten stimmen mit einem möglichen Mechanismus überein, der einen Mangel an Proteinsynthese und Zellwachstum beinhaltet, der anschließend mit abnormaler Autophagie und Neurodegeneration verbunden ist.
Im Vergleich zu den wenigen genetischen Tiermodellen mit LC-Degeneration, Verlust von LC-Neuronen in Gpt2-Nullmäuse ist entwicklungsmäßig am frühesten. Früher Neuronenverlust bei LC in einem Modell menschlicher neurometabolischer Erkrankungen liefert wichtige Hinweise auf die metabolische Anfälligkeit von LC und kann zu neuen therapeutischen Zielen führen.