Pfizer beantragt bei der FDA die Zulassung für den Notfall seiner Covid-Pille, die das Risiko von Krankenhausaufenthalten und Todesfällen um 90 % senken kann
- Pfizer hat am Dienstag seinen Antrag auf Zulassung seiner COVID-19-Pille bei der FDA eingereicht
- Die Pille namens Paxlovid wirkt, indem sie ein Enzym hemmt, mit dem das Coronavirus Kopien von sich selbst in menschlichen Zellen anfertigt
- Klinische Studiendaten zeigten, dass das Medikament die Krankenhauseinweisungs- und Sterberate durch das Virus um fast 90 % senken kann
- Es kommt am selben Tag, an dem Pfizer einen Vertrag mit der von den Vereinten Nationen unterstützten Gruppe Medicines Patent Pool unterzeichnet hat, um Generikaherstellern die Produktion der Pille für den Einsatz in 95 Ländern zu ermöglichen
Pfizer Inc hat am Dienstag bei der US-amerikanischen Food and Drug Administration einen Antrag auf Zulassung seiner COVID-19-Pille für den Notfall eingereicht.
Jüngste Daten aus klinischen Studien haben ergeben, dass das Medikament die Krankenhauseinweisungs- und Sterberate durch das Virus um fast 90 Prozent senken kann.
Darüber hinaus kann es in Städten und Ländern mit eingeschränktem Zugang zu Impfstoffen oder niedrigen Impfraten zu einem wichtigen Instrument werden.
Albert Bourla, CEO von Pfizer, hatte heute gesagt, dass das Unternehmen plant, der FDA vor Thanksgiving Daten zu übermitteln.
Pfizer hat am Dienstag seinen Antrag auf Zulassung seiner COVID-19-Pille bei der FDA eingereicht (Dateibild)
Die Pille namens Paxlovid (oben) wirkt, indem sie ein Enzym hemmt, das das Coronavirus verwendet, um Kopien von sich selbst in menschlichen Zellen herzustellen
Der Kandidat von Pfizer, der Paxlovid genannt wird, gehört zu einer Klasse von Medikamenten, die als Protease-Hemmer bekannt sind.
Die Pille würde wirken, indem sie ein Enzym hemmt, mit dem das Coronavirus Kopien von sich selbst in menschlichen Zellen anfertigt.
Protease-Inhibitoren haben sich bei der Behandlung anderer viraler Krankheitserreger wie HIV und Hepatitis-C-Virus sowohl allein als auch in Kombination mit anderen antiviralen Mitteln als wirksam erwiesen, so das Unternehmen.
Anfang dieses Monats veröffentlichte der Arzneimittelhersteller vorläufige Ergebnisse seiner Studie mit 775 Erwachsenen, die an leichtem bis mittelschwerem COVID-19 erkrankt waren.
Alle Teilnehmer waren ungeimpft und galten aufgrund von Grunderkrankungen wie Fettleibigkeit und Diabetes als einem hohen Risiko für einen Krankenhausaufenthalt.
Die Patienten wurden innerhalb von drei bis fünf Tagen nach Meldung der ersten Symptome und insgesamt fünf Tage lang behandelt.
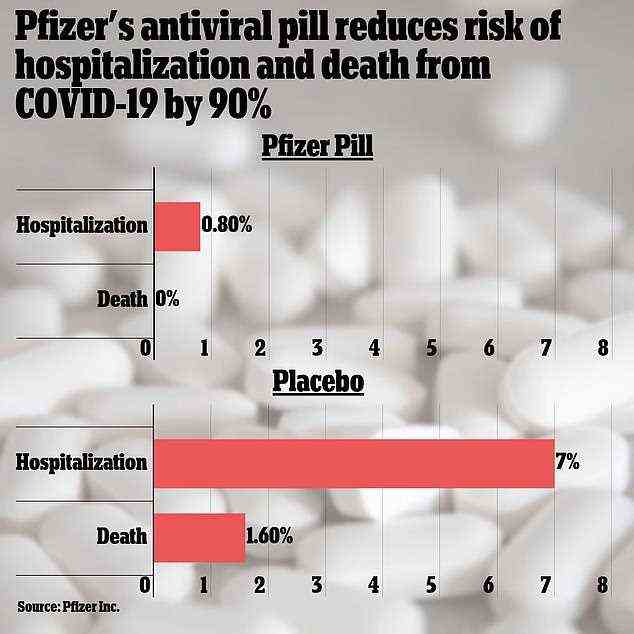
Patienten, die Pfizers Medikament zusammen mit einem antiviralen HIV-Medikament einnahmen, sahen nach einem Monat im Vergleich zur Placebo-Gruppe ein um 89 Prozent verringertes Risiko für einen Krankenhausaufenthalt oder Tod.
Nur 0,8 Prozent der Patienten, die das Medikament einnahmen, mussten ins Krankenhaus eingeliefert werden, und niemand starb.
In der Vergleichsgruppe wurden sieben Prozent ins Krankenhaus eingeliefert und es gab sieben Todesfälle.
Pfizer lieferte keine detaillierten Nebenwirkungen, sagte jedoch, dass die Raten in jeder Gruppe bei etwa 20 Prozent lagen.
Pfizer Inc hat Anfang dieses Monats die Ergebnisse klinischer Studien veröffentlicht, die zeigen, dass seine antivirale Pille die Krankenhauseinweisungen und die Sterblichkeitsrate um 89 % reduziert hat
Die Ergebnisse der Studie waren so beeindruckend, dass Pfizer sie vorzeitig abbrach, um eine Genehmigung für ihre Verwendung einzuholen.
Dies ist die zweite Pille, die sich bei der Behandlung der Krankheit als wirksam erwiesen hat, nachdem Merck & Co letzten Monat angekündigt hatte, dass sein experimentelles antivirales Mittel das Risiko schwerer Erkrankungen und Todesfälle um die Hälfte reduzieren könnte.
Die Pille von Merck wurde seitdem vom Vereinigten Königreich genehmigt und wird voraussichtlich von der FDA während einer für den 30. November geplanten Sitzung zugelassen.
Es ist unklar, wie schnell die FDA die Pille von Pfizer zulassen wird.
Pfizer hat auch die Zulassung in Australien, Neuseeland und Südkorea beantragt und plant, Anträge in weiteren Ländern einzureichen.
“Wir bemühen uns so schnell wie möglich, diese potenzielle Behandlung in die Hände der Patienten zu bringen, und wir freuen uns darauf, mit der FDA bei der Prüfung unseres Antrags zusammen mit anderen Zulassungsbehörden auf der ganzen Welt zusammenzuarbeiten”, sagte Bourla in einer Pressemitteilung.
Die Nachricht kommt am selben Tag, nachdem Pfizer bekannt gegeben hat, dass es einen Vertrag mit einer von der UNO unterstützten Gruppe unterzeichnet hat, um anderen Unternehmen die Herstellung ihrer COVID-19-Pille zu ermöglichen.
Der Deal mit dem in Genf ansässigen Medicines Patent Pool würde es Generikaherstellern ermöglichen, die Pille zu produzieren, damit sie an 95 Länder mit niedrigem und mittlerem Einkommen geliefert werden könnte.
Darüber hinaus erhält Pfizer keine Lizenzgebühren für Verkäufe in Ländern mit niedrigem Einkommen und verzichtet auf Lizenzgebühren für Verkäufe in allen unter das Abkommen fallenden Ländern, solange das Coronavirus als Notfall für die öffentliche Gesundheit gilt.