Ein genauer Blick auf ein Protein zeigt, wie es molekulare Passagiere in Zellen in den Nieren, im Gehirn und anderswo transportiert.
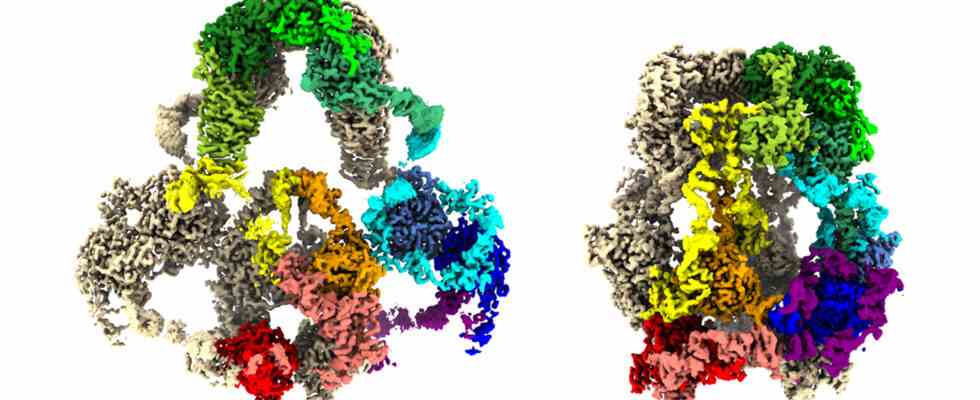
Das Protein LRP2 ist Teil eines Lieferdienstes, der bestimmte Moleküle außerhalb einer Zelle einfängt und sie hinein befördert. Jetzt zeigen 3-D-Karten von LRP2 die Struktur des Proteins und wie es Moleküle einfängt und freisetzt, berichten Forscher am 6. Februar in Zelle. Das Protein nimmt bei dem nahezu neutralen pH-Wert außerhalb der Zellen eine offenere Form wie ein Netz an. Aber in der sauren Umgebung in den Zellen zerknittert das Protein, um Passagiere abzusetzen.
Science News-Schlagzeilen in Ihrem Posteingang
Schlagzeilen und Zusammenfassungen der neuesten Science News-Artikel, die jeden Donnerstag an Ihren E-Mail-Posteingang gesendet werden.
Danke fürs Anmelden!
Bei der Anmeldung ist ein Problem aufgetreten.
Die Form der Struktur von LRP2 – und wie sie so viele Funktionen ermöglicht – hat Wissenschaftler seit Jahrzehnten verblüfft. Das Protein hilft den Nieren und dem Gehirn, giftige Substanzen herauszufiltern, und wirkt auch an anderen Stellen, wie der Lunge und den Innenohren. Wenn das Protein nicht richtig funktioniert, können eine Vielzahl von Gesundheitsproblemen auftreten, darunter chronische Nierenerkrankungen und das Donnai-Barrow-Syndrom, eine genetische Störung, die die Nieren und das Gehirn betrifft.
Die verschiedenen Zustände, die mit der LRP2-Dysfunktion verbunden sind, stammen von den zahlreichen Verantwortlichkeiten des Proteins – es bindet an mehr als 75 verschiedene Moleküle. Das ist eine enorme Menge für ein Protein, was ihm den Spitznamen „molekulares Fliegengitter“ einbrachte, sagt der Nephrologe Jonathan Barasch von der Columbia University.
Typischerweise sitzt LRP2 an der Oberfläche einer Zellmembran und wartet darauf, sich ein vorbeiziehendes Molekül zu schnappen. Nachdem das Protein an ein Molekül gebunden hat, verschlingt die Zelle den Teil ihrer Oberfläche, der das Protein enthält, und bildet eine innere Blase, die als Endosom bezeichnet wird. LRP2 setzt dann das Molekül innerhalb der Zelle frei, und das Endosom trägt das Protein zurück an die Oberfläche.
Um dieses Shuttle-System zu verstehen, sammelten Barasch und Kollegen LRP2 aus 500 Mäusenieren. Die Forscher brachten einen Teil des Proteins in eine Lösung mit einem extrazellulären pH-Wert von 7,5 und einen Teil in eine Lösung, die Endosomen nachahmt, mit einem pH-Wert von 5,2. Mit einem Kryo-Elektronenmikroskop nahmen sie Bilder der Proteine auf und fügten die Bilder dann in einem Computer zusammen, um 3-D-Karten des Proteins sowohl in offenen als auch in geschlossenen Formationen zu erstellen.
Die Forscher vermuten, dass geladene Calciumatome das Protein bei extrazellulärem pH-Wert offen halten. Aber wenn der pH-Wert aufgrund von Wasserstoffionen, die in das Endosom fließen, abfällt, verdrängen die Wasserstoffionen die Calciumionen, wodurch sich das Protein zusammenzieht.